1) N
2) S
3) Сl
4) Mg
10.Молекула, в которой электронная плотность смещена к атому фосфора, – это
1) PF 3
2) РН 3
3) P 2S 3
4) Р 2O 3
11. Высшаястепень окисления элементов проявляется в наборе оксидов и фторидов
1) СlO 2, РСl 5, SeCl 4, SO 3
2) PCl, Аl 2O 3, КСl, СО
3) SeO 3, ВСl 3, N 2O 5, СаСl 2
4) AsCl 5, SeO 2, SCl 2, Cl 2O 7
12. Низшаястепень окисления элементов – в их водородных соединениях и фторидах набора
1) ClF 3, NH 3, NaH, OF 2
2) H 3S +, NH+, SiH 4, H 2Se
3) CH 4, BF 4, H 3O +, PF 3
4) PH 3, NF+, HF 2, CF 4
13.Валентность для многовалентного атома одинаковав ряду соединений
1) SiH 4– AsH 3– CF 4
2) РН 3– BF 3– ClF 3
3) AsF 3– SiCl 4– IF 7
4) H 2O – BClg – NF 3
14.Укажите соответствие между формулой вещества или иона и степенью окисления углерода в них

3. Молекулы. Химическая связь. Строение веществ
Химические частицы, образованные из двух или нескольких атомов, называются молекулами(реальными или условными формульными единицамимногоатомных веществ). Атомы в молекулах химически связаны.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. Каждая химическая связь в структурных формулахпредставляется валентной чертой,например:
H – H (связь между двумя атомами водорода);
H 3N – Н +(связь между атомом азота молекулы аммиака и катионом водорода);
(К +) – (I -) (связь между катионом калия и иодид-ионом).
Химическая связь образуется парой электронов (•), которая в электронных формулах сложных частиц (молекул, сложных ионов) обычно заменяется валентной чертой, в отличие от собственных, неподеленных электронных пар атомов, например:
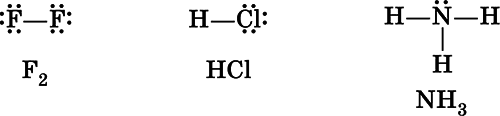
Химическая связь называется ковалентной,если она образована путем обобществления пары электронов обоими атомами.
В молекуле F 2оба атома фтора имеют одинаковую электроотрицательность, следовательно, обладание электронной парой для них одинаково. Такую химическую связь называют неполярной, так как у каждого атома фтора электронная плотностьодинакова и в электронной формулемолекулы может быть условно разделена между ними поровну:
В молекуле хлороводорода НСl химическая связь уже полярная,так как электронная плотность на атоме хлора (элемента с большей электроотрицательностью) значительно выше, чем на атоме водорода:
Ковалентная связь, например Н – Н, может быть образована путем обобществления электронов двух нейтральных атомов:
или
Такой механизм образования связи называется обменнымили равноценным.
По другому механизму та же ковалентная связь H – H возникает при обобществлении электронной пары гидрид-иона H катионом водорода Н +:
или
Катион Н +в этом случае называют акцептором,а анион Н – доноромэлектронной пары. Механизм образования ковалентной связи при этом будет донорно-акцепторным,или координационным.
Одинарные связи (Н – Н, F – F, Н – CI, Н – N) называются а-связями,они определяют геометрическую форму молекул.
Двойные и тройные связи (
) содержат одну ?-составляющую и одну или две ?-составляющие; ?-составляющая, являющаяся основной и условно образующаяся первой, всегда прочнее ?-составляющих.
Физическими (реально измеряемыми) характеристиками химической связи являются ее энергия, длина и полярность.
Энергия химической связи( Е св) – это теплота, которая выделяется при образовании данной связи и затрачивается на ее разрыв. Для одних и тех же атомов одинарная связь всегда слабее, чем кратная (двойная, тройная).
Длина химической связи( l св) – межъядерное расстояние. Для одних и тех же атомов одинарная связь всегда длиннее, чем кратная.
Полярностьсвязи измеряется электрическим дипольным моментом р– произведением реального электрического заряда (на атомах данной связи) на длину диполя (т. е. длину связи). Чем больше дипольный момент, тем выше полярность связи. Реальные электрические заряды на атомах в ковалентной связи всегда меньше по значению, чем степени окисления элементов, но совпадают по знаку; например, для связи H +I—Cl -Iреальные заряды равны Н +0' 17—Сl -0' 17(двухполюсная частица, или диполь).
Полярность молекулопределяется их составом и геометрической формой.
Неполярными (р = O) будут:
а) молекулы простыхвеществ, так как они содержат только неполярные ковалентные связи;
б) многоатомныемолекулы сложныхвеществ, если их геометрическая форма симметрична.
Например, молекулы СО 2, BF 3и СН 4имеют следующие направления равных (по длине) векторов связей:
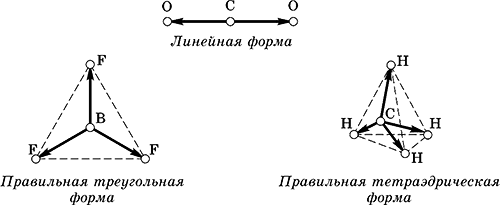
При сложении векторов связей их сумма всегда обращается в нуль, и молекулы в целом неполярны, хотя и содержат полярные связи.
Полярными (р> O) будут:
а) двухатомныемолекулы сложныхвеществ, так как они содержат только полярные связи;
б) многоатомныемолекулы сложныхвеществ, если их строение асимметрично,т. е. их геометрическая форма либо незавершенная, либо искаженная, что приводит к появлению суммарного электрического диполя, например у молекул NH 3, Н 2О, HNО 3и HCN.
Сложные ионы, например NH 4 +, SO 4 2-и NO 3 -, не могут быть диполями в принципе, они несут только один (положительный или отрицательный) заряд.
Ионная связьвозникает при электростатическом притяжении катионов и анионов почти без обобществления пары электронов, например между К +и I -. У атома калия – недостаток электронной плотности, у атома иода – избыток. Такую связь считают предельнымслучаем ковалентной связи, поскольку пара электронов находится практически во владении у аниона. Такая связь наиболее характерна для соединений типичных металлов и неметаллов (CsF, NaBr, CaO, K 2S, Li 3N) и веществ класса солей (NaNО 3, K 2SО 4, СаСО 3). Все эти соединения при комнатных условиях представляют собой кристаллические вещества, которые объединяют общим названием ионные кристаллы(кристаллы, построенные из катионов и анионов).