• окисление углеводородов:
а)
б)
Кроме того, муравьиную кислоту получают по схеме:
а уксусную кислоту – по реакции:
Применяют муравьиную кислотукак протраву при крашении шерсти, консервант фруктовых соков, отбеливатель, дезинфекционный препарат. Уксусную кислотуиспользуют как сырье в промышленном синтезе красителей, медикаментов, ацетатного волокна, негорючей кинопленки, органического стекла. Натриевые и калиевые соли высших карбоновых кислот – основные компоненты мыла.
Сложные эфиры– продукты обменного взаимодействия карбоновых кислот со спиртами. Это взаимодействие называется реакцией этерификации:
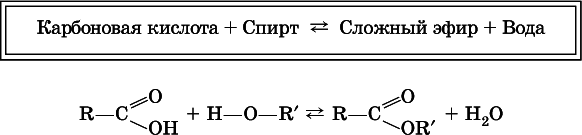
Механизм реакции этерификации был установлен при использовании спирта, меченного изотопом 18O; этот кислород после реакции оказался в составе эфира(а не воды):
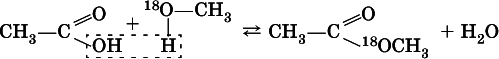
Следовательно, в отличие от реакции нейтрализации неорганической кислоты щелочью (Н ++ ОН -= Н 2O), в реакции этерификации карбоновая кислота всегда отдает группу ОН, спирт – атом Н(образуется вода). Реакция этерификации обратима; она лучше протекает в кислотнойсреде, обратная реакция ( гидролиз, омыление) – в щелочной среде.
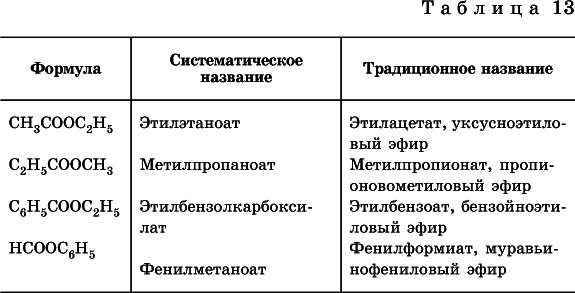
Формулыи названияраспространенных сложных эфиров приведены в табл. 13.
Среди сложных эфиров есть бесцветные низкокипящие горючие жидкости с фруктовым запахом, например:
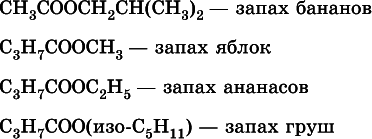
Используются сложные эфиры как растворители для лаков, красок и нитратов целлюлозы, носители фруктовых ароматов в пищевой промышленности.
Сложные эфиры трехатомного спирта – глицерина и высших карбоновых кислот (в общем виде RCOOH), например с формулами и названиями:

носят названия жиров.Примером жира будет смешанный сложный эфир глицерина и этих кислот:

Чем выше содержание остатков олеиновой кислоты (или других ненасыщенных кислот), тем ниже температура плавления жира. Жидкие при комнатной температуре жиры называются маслами.Путем гидрогенизации, т. е. присоединения водорода по двойной связи, масла превращают в твердые жиры (например, растительное масло – в маргарин). Реакция этерификации (образования жира) обратима:

Прямая реакция лучше идет в кислотнойсреде, обратная реакция – гидролиз, или омыление, жира – в щелочнойсреде; при пищеварении жир омыляется (расщепляется) с помощью ферментов.
10.4. Углеводы
Углеводы( сахара) – важнейшие природные соединения, состоящие из углерода, водорода и кислорода. Углеводы подразделяются на моносахариды, дисахариды и полисахариды. Моносахариды не подвергаются гидролизу, а остальные углеводы при кипячении в присутствии кислот расщепляются до моносахаридов.
Моносахариды(и все другие углеводы) относятся к полифункциональным соединениям. В молекуле моносахарида имеются функциональные группы разных типов: группы ОН(спиртовая функция) и группы СО(альдегидная или кетонная функция). Поэтому различают альдозы(альдегидоспирты, спиртоальдегиды) и кетозы(кетоноспирты, спиртокетоны).
Важнейший представитель альдоз — глюкоза:
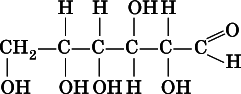
а представитель кетоз — фруктоза:
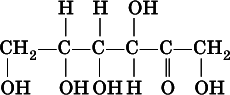
Глюкоза (виноградный сахар)и фруктоза (фруктовый сахар)являются структурными изомерами, их молекулярная формула С 6Н 12O 6.
Глюкозу можно отличить от фруктозы так же, как любой альдегид от кетона, – по реакции «серебряного зеркала» в аммиачном растворе Ag 2O:

Этерификация глюкозы и фруктозы (например, уксусной кислотой) приводит к образованию сложных эфиров по всем пяти группам ОН (заменяются на ОСОСН 3).
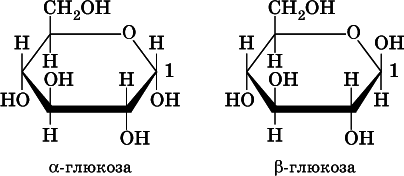
Однако не все реакции, характерные для альдегидов, протекают с глюкозой; например, не идет реакция присоединения с участием гидросульфита натрия. Причина в том, что молекула глюкозы может существовать в трех изомерных формах, из которых две формы (? и ?) – циклические. В растворе все три формы находятся в состоянии равновесия, причем открытая (альдегидная) форма, приведенная выше, содержится в наименьшемколичестве:

Циклические формы глюкозы не содержат альдегидной группы. Они отличаются друг от друга только пространственным расположением атома Н и группы ОН у атома углерода C 1(рядом с кислородом в цикле):
Дисахаридыобразуются из двух молекул моносахаридов путем межмолекулярной дегидратации. Так, сахароза(обычный сахар)C 12Н 22О 11является продуктом соединения остатков глюкозы и фруктозы за счет отщепления воды:

При гидролизе в кислотной среде сахароза вновь переходит в моносахариды:
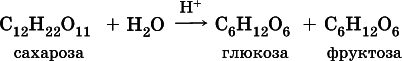
Получившаяся смесь — инвертный сахар– содержится в мёде. При 200 °C сахароза, теряя воду, превращается в бурую массу (карамель).
Полисахариды – крахмали целлюлоза (клетчатка) –продукты поликонденсации (межмолекулярной дегидратации) соответственно ?– и ?-форм глюкозы, их общая формула (С 6Н 10О 5) n. Степень полимеризации крахмала составляет 1000–6000, а целлюлозы 10 000—14 000. Целлюлоза – наиболее распространенное в природе органическое вещество (в древесине массовая доля целлюлозы доходит до 75 %). Крахмал (легче) и целлюлоза (труднее) подвергаются гидролизу (условия: H 2SO 4или НCl, > 100 °C); конечный продукт – глюкоза.