
Молекулы жидких одноатомных спиртов ROH ассоциированы за счет водородных связей:

(эти связи аналогичны водородным связям в чистой воде).
При растворении в воде молекулы ROH образуют водородные связи с молекулами воды:

Водные растворы спиртов ROH имеют нейтральную среду; другими словами, спирты практически не диссоциируют в водном растворе ни по кислотному, ни по основному типу.
Химические свойства одноатомных спиртов обусловлены присутствием в них функциональной группы ОН.
Водород группы ОН в спиртах может замещаться на металл:
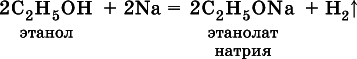
Этанолаты и производные других спиртов (алкоголяты)легко гидролизуются:
Группу ОН в спиртах можно заместить на Cl или Br:
При действии на спирты водоотнимающих средств, например концентрированной H 2SO 4, происходит межмолекулярная дегидратация:

Продукт реакции — диэтиловый эфир(С 2Н 5) 2O – относится к классу простых эфиров.
В более жестких условиях дегидратация становится внутримолекулярнойи образуется соответствующий алкен:

Многоатомные спиртырассмотрим на примере простейших представителей двух– и трехатомных спиртов:
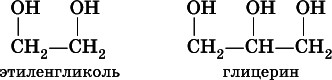
При комнатной температуре они – бесцветные вязкие жидкости с температурами кипения 198 и 290 °C соответственно, неограниченно смешиваются с водой. Этиленгликоль ядовит.
Химические свойства многоатомных спиртов подобны свойствам спиртов ROH. Так, в этиленгликоле одну или две группы ОН можно заместить на галоген:
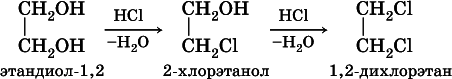
Кислотные свойства многоатомных спиртов проявляются в том, что (в отличие от одноатомных спиртов) водород группы ОН замещается на металл под действием не только металлов, но и гидроксидов металлов:
а)

б)

(стрелками в формуле гликолята меди показано образование ковалентных связей медь – кислород по донорно-акцепторному механизму).
Аналогично реагирует с гидроксидом меди (II) глицерин:

Гликолят и глицерат меди (II), имеющие ярко-синюю окраску, позволяют качественно обнаруживатьмногоатомные спирты.
Получениеодноатомных спиртов в промышленности– гидратация алкенов в присутствии катализаторов (H 2SO 4, Al 2O 3), причем присоединение воды к несимметричным алкенам происходит по правилу Марковникова:
(способ получения вторичного спирта), или присоединение к алкенам СО и Н 2в присутствии кобальтового катализатора (процесс называется гидрофоржилирование):
(способ получения первичного спирта).
В лаборатории(а иногда и в промышленности) спирты получают взаимодействием галогенпроизводных углеводородов с водой или водным раствором щелочи при нагревании:

Этанол С 2Н 5ОН образуется также при спиртовом брожениисахаристых веществ, например глюкозы:
Этиленгликоль получают в двухстадийном процессе:
а) окисление этилена:
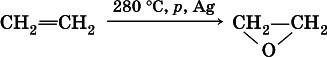
б) гидратация этиленоксида:
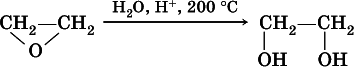
Глицерин ранее получали омылением жиров (см. 20.3), современный трехстадийный способ – постепенное окисление пропена (приведена только схема процесса):

Спирты используют как сырье в органическом синтезе, в качестве растворителей (для лаков, красок и т. п.), а также в бумажной, полиграфической, парфюмерной, фармакологической и пищевой промышленности.
Простые эфиры– класс органических соединений, содержащих мостиковый атом кислорода – О– между двумя углеводородными радикалами: R – О—R'. Самый известный и широко применяемый простой эфир – диэтиловый эфирС 2Н 5—О – С 2Н 5. Бесцветная, легкоподвижная жидкость с характерным («эфирным») запахом, в лабораторной практике его называют просто эфиром. Почти не смешивается с водой, t кип= 34,51 °C. Пар эфира воспламеняется на воздухе. Получают диэтиловый эфир при межмолекулярной дегидратации этанола (см. выше), основное применение – растворитель.
Фенолы– это спирты, в которых группа ОН непосредственно связана с бензольным кольцом. Простейший представитель — фенолС 6Н 5—ОН. Белые (розовеющие на свету) кристаллы с сильным запахом, t пл= 41 °C. Вызывает ожоги кожи, ядовит.
Для фенола характерна значительно большая кислотность, чем для ациклических спиртов. Вследствие этого фенол в водном растворе легко реагирует с гидроксидом натрия:
Отсюда тривиальное название фенола — карболовая кислота.
Отметим, что группа ОН в феноле никогда не замещается ни на какие другие группы или атомы, но делает более подвижнымиатомы водорода бензольного кольца. Так, фенол легко реагирует с бромом в воде и азотной кислотой, образуя соответственно 2,4,6-трибромфенол (I) и 2,4,6-тринитрофенол (II,традиционное название — пикриновая кислота):

Фенол в промышленностиполучают нагреванием хлорбензола с раствором гидроксида натрия под давлением при 250 °C: