В XVII в., когда, как мы знаем, возникло современное естествознание, идеи атомизма, высказанные Демокритом и распространённые Эпикуром, получили признание среди первых естествоиспытателей. Одним из первых мыслителей, возродивших атомизм, был французский философ и учёный Пьер Гассенди (1592–1655). Также необходимо отметить большой вклад в эту область знания основателя и многолетнего президента Лондонского Королевского общества Роберта Бойля (1627–1691). Широкую известность он получил благодаря открытию закона сжатия газов, известного под названием закона Бойля – Мариотта, однако его исследования во многом были посвящены изучению строения вещества. Бойль полагал, что все вещества состоят из материальных частиц, имеющих определённую величину и форму, причём атомы жидкостей находятся в постоянном движении, а твёрдых тел – в покое. Он впервые объяснил химические изменения вещества соединением и разъединением атомов, что нашло подтверждение в последующих химических исследованиях. Сторонником атомизма был также Ньютон, который говорил, что материю следует считать «пористой», т. е. состоящей из отдельных крупинок, погружённых в пустое пространство.
К концу XVIII в. стало складываться убеждение, что вещества состоят из мелких частиц, которые называли корпускулами или молекулами. Эти частицы могут распадаться на более мелкие частицы – атомы, которые уже не могут быть разделены. Горячим сторонником атомно-молекулярной теории был российский учёный, внёсший неоценимый вклад в становление российской науки и культуры, Михаил Васильевич Ломоносов (1711–1765) (рис. 99). Он утверждал, что все вещества состоят из корпускул, которые являются собранием элементов. Позже Ломоносов заменил слово «корпускула» на «молекула», а «элемент» на «атом».
В 1860 г. на международном съезде физиков в Германии было принято определение молекулы как наименьшей частицы вещества, сохраняющей его химические свойства, и атома как наименьшей части химического элемента, входящей в состав простых и сложных веществ.
До конца позапрошлого века исследователи только констатировали существование в материи мельчайших неделимых частиц, но всерьёз не ставили вопроса об их строении. Между тем уже с начала XIX в. накапливались данные, свидетельствующие о том, что электричество, так же как и вещество, состоит из мелких неделимых зарядов. Впервые мысль о дискретной структуре электричества высказал в 1801 г. немецкий физик Иоганн Риттер, а в 1846 г. его соотечественник Вильгельм Вебер ввёл понятие атома электричества. К концу XIX в., в значительной мере благодаря опытам Фарадея, было окончательно установлено, что существуют наименьшие, неделимые дальше, электрические заряды.

Рис. 99. М. В. Ломоносов
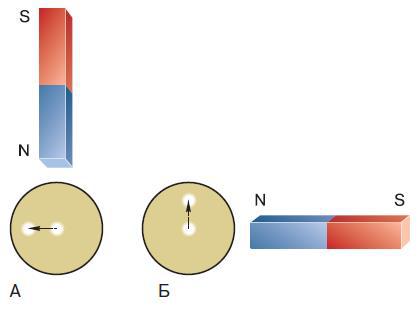
Рис. 100. След катодного луча (обозначен светлым кружком) из центра смещается под действием магнитного поля.
Северный полюс магнита поднесён к лучу, направленному на наблюдателя: А – луч отклоняется влево; Б – луч отклоняется вверх
В 1881 г. английский физик Дж. Стони рассчитал величину этих зарядов и впоследствии предложил назвать их электронами.
Одновременно проводились исследования излучения, которое было названо катодными лучами. Катодные лучи испускаются в вакууме из отрицательно заряженного тела (катода). Было ясно, что они отрицательно заряжены, так как под действием магнитного поля отклоняются в определённую сторону (рис. 100). В 1895 г. французский физик Жан Перрен экспериментально доказал, что катодные лучи – это поток отрицательно заряженных частиц. В том же году английский исследователь Джозеф Джон Томсон начал в Кембриджском университете подробные исследования катодных лучей и уже через два года опубликовал работу, в которой доказал, что все частицы, которыми они образованы, одинаковы и что эти частицы входят в состав вещества.
Таким образом, выяснилось, что атомы не являются неделимыми – в их состав входят более мелкие частицы, которые имеют отрицательный заряд. Эти частицы оказались по сути теми же частицами, которые описывал Стони, и за ними было сохранено данное им название электронов.
Известно, однако, что атомы в целом электрически нейтральны. Следовательно, кроме отрицательных зарядов, в них должны существовать и компенсирующие их положительные. Исходя из этого, Дж. Дж. Томсон в 1903 г. предложил первую модель атома, получившую название «пудинг с изюмом». Исходя из того, что масса электрона оказалась значительно меньше массы атома, он предположил, что атомы представляют собой массивную частицу, в которой равномерно распределён положительный электрический заряд и в которую, подобно изюминам в пудинге, вкраплены значительно более лёгкие, отрицательно заряженные электроны. При определённых условиях электроны могут вылетать из атомов и двигаться прямолинейно с большой скоростью. Это движение электронов и обнаруживается в виде катодных лучей.
1. Какими древнегреческими философами было высказано предположение о существовании атомов?
2. Какие исследователи развивали идеи атомизма в XVI–XVII вв.?
3. Что представляют собой «катодные лучи»?
4. Какую модель атома предложил Дж. Дж. Томсон? Изобразите её схематично.
§ 39 Открытие радиоактивности и модель атома Резерфорда
Модель атома, предложенная Томсоном, просуществовала почти десять лет. Но за это время накопились новые научные факты, которые эта модель объяснить не могла, например радиоактивность. Первооткрывателем этого явления можно считать французского физика Антуана Анри Беккереля (1852–1908). В 1896 г. ему удалось случайно обнаружить, что соли урана обладают свойством засвечивать в полной темноте фотографическую пластинку. Так как интенсивность почернения пластинки не зависела от того, какая именно соль урана использовалась, Беккерель пришёл к выводу, что сам по себе металл, называемый ураном, испускает какое-то излучение. Первоначальное предположение, что это излучение является рентгеновским, не подтвердилось. Стало ясно, что уран испускает излучение, до тех пор неизвестное. Исследования Беккереля были продолжены супругами Пьером Кюри (1859–1906) и Марией Склодовской – Кюри (1867–1934) (рис. 101). Им удалось обнаружить ещё три химических элемента, испускающих невидимые лучи.

Рис. 101. Пьер и Мари Кюри в лаборатории

Рис. 102. Эрнест Резерфорд
Этими элементами оказались торий, радий и полоний. Излучение было названо радиоактивным, а само явление – радиоактивностью. Впоследствии оказалось, что радиоактивное излучение способны испускать многие элементы, имеющие большой атомный вес. У некоторых элементов, не обладающих радиоактивностью в обычных условиях, она возникает после того, как они сами были облучены радиоактивным излучением. Это явление получило название искусственной радиоактивности.
Природа радиоактивности стала главным предметом изучения английского физика новозеландского происхождения Эрнеста Резерфорда (1871–1937) (рис. 102), работавшего в той же лаборатории Кембриджского университета, что и Томсон. В 1899 г. ему удалось установить, что радиоактивное излучение состоит по крайней мере из двух составляющих, которые он назвал альфа- и бета-излучением. Оба эти вида излучения состояли из электрических зарядов, так как отклонялись под действием магнитного поля. Вскоре была обнаружена и третья составляющая радиоактивности, не имеющая электрического заряда, которую по аналогии назвали гамма-излучением. В дальнейшем удалось выяснить, что альфа-лучи являются потоком атомных ядер химического элемента, называемого гелием, бета-лучи – потоком электронов, т. е. катодными лучами, а гамма-лучи, как вы уже знаете, представляют собой электромагнитное излучение очень высокой частоты. Разделить суммарное радиоактивное излучение на эти три составляющие в эксперименте несложно. Для этого нужно пропустить пучок излучения через магнитное поле. Препарат радия помещают на дно узкого канала в куске свинца. Напротив канала находится фотопластинка. На выходящее из канала излучение действует сильное магнитное поле, под действием которого пучок распадается на три пучка (рис. 103). Два из них отклоняются в противоположные стороны, что указывает на наличие у этих излучений электрических зарядов противоположных знаков. При этом отрицательный компонент излучения (бета– лучи) отклоняется магнитным полем гораздо сильнее, чем положительный (альфа-лучи). Третья, нейтральная составляющая (гамма– лучи) не отклоняется магнитным полем.