Элементы, которые склонны к отдаче электронов, называют металлами, а те, которые способны их принимать, – неметаллами. Атомы многих элементов, например углерода, серы, примерно с равной вероятностью могут и отдавать, и принимать электроны. Чёткой границы между металлами и неметаллами не существует.
Наиболее распространённым и наглядным примером взаимодействия металлов и неметаллов является процесс, который происходит при контакте щелочного металла с галогеном. Металл легко отдаёт свой единственный внешний электрон, а галоген присоединяет его как единственный недостающий. В результате образуется положительно заряженный ион металла (катион) и отрицательно заряженный ион галогена (анион)[11]. Имея разноимённые заряды, эти ионы притягиваются друг к другу. В результате получаются соли, примером которой является хлорид натрия (поваренная соль). Хлорид натрия состоит из кристаллов, в состав которых входят катионы натрия Na+ и анионы хлора Cl- (рис. 125). При растворении хлорида натрия в воде его кристаллы распадаются на ионы. Процесс распада молекул или ионных кристаллов веществ на ионы при растворении в воде называют электролитической диссоциацией.

Рис. 125. Схема электролитической диссоциации хлорида натрия
Таким образом, в растворе поваренной соли нет молекул хлорида натрия, а присутствуют только ионы натрия и хлора, окружённые молекулами воды (см. рис. 125). Слово «диссоциация» здесь означает распад, разделение. Вещества, способные к электролитической диссоциации, называют электролитами. Их растворы проводят электрический ток. Это становится понятным, если учесть, что ток – это перенос заряженных частиц, которыми в данном случае являются катионы и анионы. Электролитической диссоциации при растворении в воде подвергается не только соли, но также кислоты и основания.
1. В каких случаях при протекании химических реакций атом чаще отдаёт, а в каких – присоединяет электроны?
2. Почему гелий и другие благородные газы почти не способны вступать в химические реакции?
3. Чем определяются реакции окисления и восстановления?
Опираясь на рисунок 125, опишите, какую роль играет вода в процессе электролитической диссоциации.
§ 49 Валентность. Химическая связь
Внешняя электронная оболочка атома, которая соответственно и определяет его химические свойства, может содержать не более восьми электронов. Исключение составляют только атомы водорода и гелия, на единственной орбитали которых может находиться не более двух электронов. С помощью внешних электронов, которые называют валентными, осуществляется химическая связь между атомами, и образуются химические соединения. Электронную оболочку, содержащую валентные электроны, называют валентной оболочкой. Слово валентность (от лат. valentia – сила) означает способность атома образовывать определённое число химических связей с другими атомами. Валентность атома определяется числом имеющихся у него валентных электронов.
У атомов элементов каждого нового периода Периодической системы Д. И. Менделеева возникает новая валентная оболочка, которой не было у атомов элементов предыдущего периода. Элементы IIIА группы – щелочные металлы – содержат на этой оболочке всего один электрон. Их атомы легко отдают этот единственный электрон, поэтому все щелочные металлы одновалентны и химически очень активны. По мере увеличения порядкового номера элемента в периоде происходит постепенное заполнение валентной оболочки. Так, элементы IIА группы содержат на внешнем уровне два электрона, IIIА группы – три электрона и т. д. Галогены находятся в VIIA группе, следовательно, их атомы содержат семь валентных электронов. Благородные газы, стоящие в конце периода в VIIIA группе (например, неон, аргон, криптон, ксенон), содержат по восемь валентных электронов. Их внешняя оболочка заполнена, поэтому они почти не обладают химической активностью. После заполнения валентной оболочки (в конце периода) у следующего элемента возникнет новая оболочка.
Процесс обмена электронами между атомами и является причиной возникновения химической связи. Один из видов химической связи – ионная связь. Это связь, возникающая между ионами в результате действия электростатических сил притяжения (рис. 126). Типичным примером вещества с ионной связью является хлорид натрия. Однако это не единственный вид химической связи. Рассмотрим молекулу, состоящую из одинаковых атомов, например молекулу водорода, имеющую формулу Н2. Каким образом два атома водорода соединяются между собой? Мы знаем, что на единственной 1 s-орбитали атома водорода могут находиться два электрона. Однако атом водорода имеет всего один электрон, и для заполнения оболочки ему нужен ещё один. В таком же положении находится и второй атом водорода.

Рис. 126. Образование ионной связи
Поэтому они как бы «договариваются» пользоваться имеющимися в их распоряжении двумя электронами сообща. Теперь в их распоряжении имеется общая орбиталь, заполненная, как ей и полагается, двумя электронами. Такая молекула обладает очень высокой устойчивостью.
Химическую связь, при которой атомы обобществляют свои валентные электроны, называют ковалентной (рис. 127, 128). В зависимости от количества общих электронных пар ковалентная связь может быть одинарной, двойной, а иногда и тройной. Многие химические вещества построены из молекул, состоящих из атомов двух элементов, одним из которых является атом кислорода. Такие вещества называются оксидами. К оксидам относятся такие хорошо известные вам вещества, как углекислый газ СО2, вода Н2О и многие другие. При образовании оксидов кислород, у которого для заполнения валентной оболочки не хватает двух электронов, охотно образует две общие электронные пары с атомами других элементов, образуя с ними двойную ковалентную связь. А вот тройные связи встречаются в химических соединениях гораздо реже и образуются преимущественно между атомами углерод – углерод, углерод – азот и азот – азот.
Многие элементы во всех соединениях проявляют одинаковую валентность. Так, водород и щелочные металлы всегда одновалентны, а кислород всегда двухвалентен. Существуют, однако, элементы с переменной валентностью. Одним из рекордсменов среди таких элементов является хлор, который находится в VIIА группе периодической системы. Хлор способен проявлять валентности от I до VII, и образует многочисленные и самые разнообразные соединения.
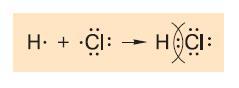
Рис. 127. Ковалентная связь возникает в результате образования общих электронных пар
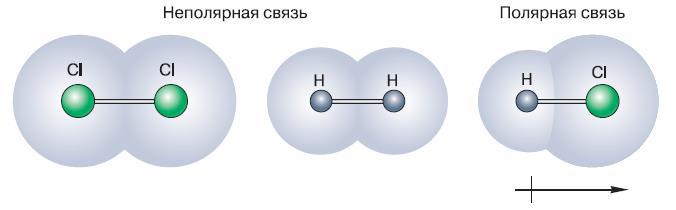
Рис. 128. При взаимодействии двух атомов одного и того же элемента– неметалла образуется неполярная ковалентная связь. При взаимодействии атомов разных элементов-неметаллов образуется полярная связь. При этом электронная пара смещается к элементу с большей электроотрицательностью
Соединяясь, например, с кислородом, он способен образовывать различные оксиды: Cl2O, ClO2, Cl2O7. Известны и другие элементы, валентность которых в различных реакциях может быть различной. Так, сера может обладать валентностями II, IV и VI, железо может быть двух– и трёхвалентным, углерод – двух– и четырёхвалентным и т. д.
11
Положительно заряженные ионы называются катионами, потому что они притягиваются к отрицательно заряженному электроду – катоду, а отрицательные анионы соответственно притягиваются к положительному электроду – аноду.