Ядро атома гелия чаще всего содержит два нейтрона, но встречаются изотопы, число нейтронов в ядре которых равно одному или трём. Кислород в природе может существовать в виде трёх изотопов с восемью, девятью или десятью нейтронами. При этом число протонов в ядре атома кислорода и, следовательно, его зарядовое число и атомный номер всегда равны восьми. Водород является первым элементом периодической системы элементов. Ядро его атома содержит всего один протон и чаще всего вообще не содержит нейтронов. Такой изотоп водорода называют протий. Однако в природном водороде содержится почти 0,02 % изотопа, называемого дейтерием и содержащего один нейтрон (рис. 115, А). Соответственно, атомная масса дейтерия равна двум.
Рассмотренные изотопы гелия, кислорода и водорода называют стабильными, так как они устойчивы и не подвергаются самопроизвольному распаду. К настоящему времени в природе обнаружено 270 стабильных изотопов. Кроме них существуют и нестабильные изотопы, ядро которых неустойчиво и подвержено постоянному распаду. Эти изотопы чаще всего встречаются у тяжёлых элементов, т. е. элементов с большой атомной массой. Нестабильные изотопы часто получают искусственно при помощи ядерных реакций. Таким способом можно получить, например, нестабильный изотоп водорода, в ядре которого находятся два нейтрона. Этот изотоп водорода называется тритием из-за того, что его атомная масса равна трём (один протон плюс два нейтрона) (см. рис. 115, А).
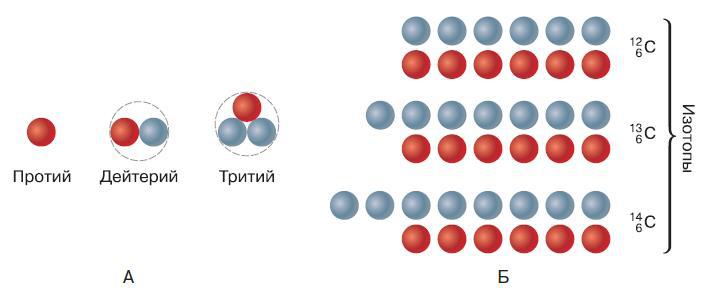
Рис. 115. Состав атомных ядер: А – водорода; Б – углерода (красные шарики – протоны, голубые – нейтроны)
Большинство природных химических элементов существуют в виде нескольких устойчивых изотопов (рис. 115, Б). Например, железо имеет четыре стабильных изотопа, ртуть – семь, а олово – десять. Поэтому атомная масса элементов выражается дробным числом. Так, хлор, встречающийся в природе, на 76,5 % состоит из изотопа с атомной массой, равной 35, и на 24,5 % – из изотопа с массой 37. Поэтому средняя атомная масса хлора равна приблизительно 35,5.
Как следует из самого названия, нестабильные изотопы не могут существовать в течение неограниченного периода времени и постоянно распадаются. Скорость распада ядер этих изотопов измеряется их периодом полураспада – временем, за которое первоначальное количество частиц уменьшается вдвое. У большинства нестабильных изотопов этот период составляет не более нескольких секунд, хотя известны изотопы с периодом полураспада в миллионы лет. Во время распада ядра таких атомов испускают радиоактивное излучение. Таким образом, можно сказать, что все неустойчивые изотопы обладают радиоактивностью (рис. 116).
Химические свойства элементов, т. е. их способность вступать в химические реакции, не зависят от числа нейтронов в ядре атома, а связаны со строением его электронной оболочки. Поэтому в химическом отношении все изотопы одного элемента являются абсолютно одинаковыми. Эту особенность используют во многих областях науки, техники и медицины. Таким образом можно, например, судить о превращениях какого-либо химического вещества в организме и о местах его включения в клетки и ткани. Можно синтезировать биологически активное вещество, включив в него неустойчивый радиоактивный изотоп какого-либо атома, например углерода или азота. В химическом и биологическом отношении это вещество ничем не будет отличаться от такого же вещества, не содержащего радиоактивного изотопа. В какие бы другие соединения это вещество ни превращалось, как бы ни изменялось строение его молекулы, радиоактивное излучение нестабильного атома всегда будет сохраняться. Если затем ввести это вещество в кровь, то, измеряя испускаемое этим изотопом слабое, безопасное для организма, радиоактивное излучение в различных участках человеческого тела, можно судить о том, где и в каких количествах накапливается в организме это вещество или продукты его обмена. Постепенно эти продукты или само вещество будут выводиться из организма, и по уменьшению радиоактивности можно определить скорость их выведения. Такой метод получил название исследования с применением «меченых атомов».
Рис. 116. Радиоактивный металл кюрий светится в темноте, испуская большое количество ядер гелия
При знакомстве со строением атомного ядра возникает естественный вопрос: с помощью каких сил нуклоны удерживаются друг около друга? Мы знаем, что протоны и электроны, будучи противоположно заряженными, взаимно притягиваются, и именно это электрическое поле определяет устойчивость атома в целом. Но поскольку все протоны заряжены одинаково положительно, они должны отталкиваться друг от друга и ядро должно немедленно разрушиться. Нейтральные нейтроны не могут вмешиваться в этот процесс, а сила гравитации настолько мала по сравнению с электромагнитной, что никак не может препятствовать этому распаду. Почему же ядро может существовать в неизменном виде миллиарды лет?
Оказывается, что в природе, помимо двух уже известных нам фундаментальных взаимодействий – гравитационного и электромагнитного, существуют ещё два типа взаимодействий, называемых сильным и слабым. Первое из них удерживает нуклоны внутри атомного ядра, а второе обнаруживается при превращениях элементарных частиц. Главной особенностью сильного взаимодействия, отличающей его от гравитационного и электромагнитного взаимодействий, является то, что оно действует только на очень малых расстояниях, соизмеримых с размером нуклонов. Эти расстояния составляют около 1015 м. На таких расстояниях эта сила становится столь огромной, что по сравнению с ней можно пренебречь всеми электромагнитными, не говоря уже о гравитационных, взаимодействиями между нуклонами. Слабое взаимодействие тоже распространяется только на очень малые расстояния, но превышает оно только силу гравитации.
1. Что происходит с атомом, если он теряет один или несколько электронов?
2. Почему атомы невозможно увидеть с помощью светового микроскопа?
3. Какими частицами определяется масса атомного ядра, а какими – его заряд?
4. Что такое период полураспада атомного ядра?
5. Какие виды взаимодействия осуществляются внутри атомного ядра и элементарных частиц?
Подберите эпиграф к данному параграфу.
§ 46 Ядерный распад и элементарные частицы
Со времён александрийской науки, т. е. с первых веков нашей эры, в Египте, Византии, а затем на Арабском Востоке и в Европе сформировалось учение, получившее название алхимии. Алхимики, в отличие от чистых философов, не только предавались абстрактным рассуждениям о строении мира, но и проводили разнообразные эксперименты (рис. 117, 118). Главной целью алхимиков было превратить широко распространённые и дешёвые вещества в дорогие благородные металлы.

Рис. 117. Лаборатория алхимика