Связь, которую образуют свободные электроны в кристаллической решётке металлов, называют металлической. В узлах кристаллической решётки металлов расположены их положительно заряженные ионы. А поскольку, как вы знаете, электроны валентной оболочки металлов не очень прочно удерживаются ядром, они отрываются и беспорядочно, подобно молекулам газа, движутся между ними. Притягивая положительные ионы, эти электроны не дают кристаллу разрушится под действием взаимного отталкивания этих ионов. Вместе с тем электроны не могут покинуть кристалл, поскольку притягиваются положительно заряженными ионами, находящимися в узлах решётки. Из-за того что во всех металлах находится большое количество свободно движущихся электронов, они, как известно, служат хорошими проводниками электрического тока.

Рис. 129. Молекула воды представляет собой диполь
Существует ещё один вид химической связи, играющий важную роль в биологических процессах. Эту связь называют водородной. Причиной возникновения таких связей является полярность некоторых молекул. Поясним данное явление на примере молекулы воды (рис. 129). Как вам известно, в этой молекуле атом кислорода удерживает возле себя два атома водорода с помощью ковалентной связи. Но поскольку ядро атома кислорода содержит восемь положительно заряженных протонов, а каждый атом водорода – только один, то под действием электрического притяжения общие электронные пары смещены от атома водорода в сторону кислорода. Из-за этого та часть молекулы, где находится атом кислорода, приобретает небольшой отрицательный заряд, а участки, соответствующие атомам водорода, – положительный. Такая молекула, различающаяся электрическими зарядами на разных своих участках, называется полярной молекулой или диполем. Представим себе теперь, что две молекулы воды оказываются рядом. Тогда отрицательный участок одной молекулы будет притягиваться к положительному участку другой, и между ними возникнет водородная связь. Аналогичная связь может возникать не только в воде, но и во многих других, в том числе и органических, соединениях. Водородные связи являются довольно слабыми, но в том случае, когда их много, они могут достаточно прочно скреплять молекулы различных веществ, что имеет большое значение для многих биологических процессов.
1. Что такое валентность?
2. Какие электроны называются валентными?
3. Как называют химическую связь, при которой атомы «обобществляют» электроны?
4. Каким образом осуществляется связь в металлических кристаллах?
Используя рисунок 129, поясните явление полярности и образование водородных связей на примере молекулы воды.
§ 50 Химические реакции
Процессы, при которых происходит разрыв связей между атомами и (или) образование новых связей, называют химическими реакциями. В отличие от ядерных, во время химических реакций ядра атомов элементов, а значит, и сами элементы остаются неизменными, меняется только их принадлежность к различным молекулам.
Химические реакции обычно описывают с помощью уравнений. Химическим уравнением называют условную запись химической реакции посредством химических знаков и формул.
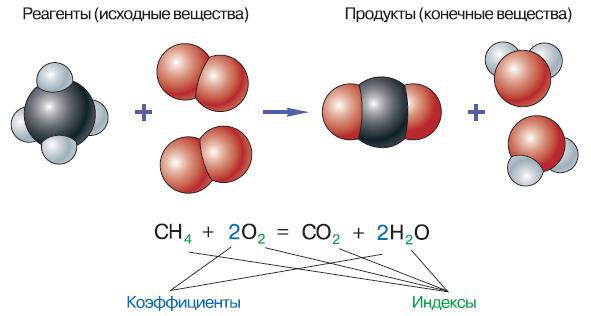
Рис. 130. Уравнение реакции и его изображение с помощью моделей
В левой части уравнения реакции записывают формулы веществ, которые вступают в реакцию (реагентов), а в правой – формулы конечных продуктов реакции (рис. 130).
Рассмотрим реакцию образования воды из кислорода и водорода. Химическая формула газообразного кислорода О2, а водорода – Н2. Составим схему реакции: Н2 + О2> Н2О. Для того чтобы она превратилась в уравнение, надо расставить коэффициенты: 2Н2 + O2 = 2H2O.
Коэффициенты в уравнении реакции показывают, в каком количественном соотношении находятся реагирующие вещества и продукты. Из полученного нами уравнения следует, что число вступающих в данную реакцию молекул водорода в два раза больше числа молекул кислорода. Смесь водорода и кислорода в соотношении 2: 1 называют гремучим газом, так как достаточно небольшого воздействия, например в виде искры, для того чтобы произошёл взрыв и образовалась вода.
Теперь разберём более сложный случай. Одним из важнейших процессов, обеспечивающих существование жизни на Земле, является осуществляемый растениями фотосинтез. В результате фотосинтеза из воды и углекислого газа образуются глюкоза и кислород. Рассмотрим схему и составим уравнение этой реакции. Формула глюкозы С6Н12О6. Следовательно, схема процесса выглядит так:
Н2О + СО2 > С6Н12О6 + О2.
Расставив коэффициенты, получаем уравнение реакции:
6H2O + 6CO2 = C6H12O6 + 6O2.
По химическим уравнениям производят различные количественные расчёты в производственной и лабораторной практике. Например, попробуем определить, сколько граммов воды и углекислого газа потребуется для синтеза 1 г глюкозы. Для этого вспомним понятие моля. Моль – это такое количество вещества, масса которого, выраженная в граммах, численно равна его атомной или молекулярной массе. Молекулярная масса глюкозы равна сумме атомных масс входящих в её молекулу элементов, т. е. 6 12 + 12 • 1 + 6 • 16 = 180. Следовательно, масса одного моля глюкозы составляет 180 г. То же самое относится к воде, масса одного моля которой равна 18 г, и к углекислому газу, масса моля которого составляет 44 г. Значит, для получения 180 г глюкозы потребуется 108 г воды и 264 г углекислого газа. Итого 372 г. Но всем известно, что материя не исчезает. Куда же делись остальные 192 г? Очевидно, что это масса выделившегося кислорода. Проверим. В реакции образовалось 6 моль О2, каждый из которых имеет массу 32 г. Итого ровно 192 г. Как видите, закон сохранения массы и в этом случае оказался справедлив. Если вы хотите теперь узнать, сколько воды и углекислого газа потребуется для образования 1 г глюкозы и сколько при этом выделится кислорода, разделите все полученные числа на 180.
Существует огромное многообразие химических реакций. Простейшие из них можно условно разделить на четыре группы: реакции соединения, разложения, замещения и обмена.
В реакциях соединения из нескольких исходных веществ образуется одно сложное вещество. Примером такого вида реакций может служить процесс образования зелёного налёта малахита (CuOH)2CO3 на поверхности бронзовых изделий (рис. 131):
2Cu + O2 + H2O + CO2 = (CuOH)2CO3.
Реакции разложения приводят к распаду молекул одного исходного сложного вещества на несколько продуктов. Такие реакции чаще протекают при нагревании. Некоторые вещества разлагаются под действием света. Так, соединения серебра на свету чернеют вследствие выделения серебра. На этом процессе основана чёрно-белая фотография.
Реакции замещения – это реакции между простым и сложным веществами, в результате которых образуются два новых вещества (простое и сложное).
Реакции обмена – это реакции взаимодействия между двумя сложными веществами, при котором они обмениваются атомами или группами атомов.