Вертикальные столбцы периодической системы – группы – образованы элементами, обладающими схожими химическими свойствами. Каждая группа делится на две подгруппы, которые раньше называли главной и побочной подгруппами. В настоящее время главную подгруппу обозначают латинской буквой А, а побочную – буквой В. Для примера рассмотрим первую группами. Щелочные металлы литий, натрий, калий, цезий, рубидий и франций образуют IA группу. Это одновалентные металлы, легко вступающие в химические реакции. В III группу входят медь, серебро и золото. Они тоже являются металлами, но их химические свойства отличаются от тех, которыми обладают щелочные металлы.
Периодический закон получил всеобщее признание не сразу. Во– первых, во время его открытия ещё ничего не было известно о строении атомов и его связи со свойствами химических элементов. Поэтому казалось, что обнаруженная Менделеевым закономерность не имеет под собой надёжной физической основы. Во-вторых, как оказалось, атомные массы некоторых элементов до этого были определены неправильно, и Менделеев взял на себя смелость изменить их, опираясь только на обнаруженную им периодическую закономерность. Он справедливо полагал, что эти вопросы найдут своё объяснение при выявлении сложной структуры атома. Впоследствии правота его утверждений подтвердилась. В-третьих, в периодической системе оказались пустые ячейки, которым не соответствовал ни один из известных на то время элементов. Менделеев предсказал, что эти элементы существуют, и действительно, в 1875 г. был открыт галлий, в 1879 г. – скандий, а в 1886 г. – германий. С середины 1880-х гг. периодический закон был окончательно признан, но полное своё объяснение он получил только после того, как стало известно строение атома.
1. Какая закономерность была положена Д. И. Менделеевым в основу открытого им периодического закона?
2. Какие элементы расположены в начале периодов в Периодической системе Д. И. Менделеева, а какие – в их конце?
3. Где в Периодической системе Д. И. Менделеева располагаются элементы со схожими химическими свойствами?
На основании сведений, полученных вами при изучении предыдущей главы, объясните, что означают числа, помещённые в каждой ячейке периодической системы. Почему многие из них являются дробными?
§ 48 Строение атома и свойства химических элементов
После того как физикам удалось многое узнать о строении атома, стало возможным применить эти знания для объяснения химических свойств элементов и теоретического обоснования Периодического закона Менделеева. Нам известно, что порядковый номер элемента в периодической системе соответствует числу протонов в его ядре (рис. 122). Так как протоны обладают положительным электрическим зарядом, а атом всегда электрически нейтрален, то положительный заряд ядра должен в точности уравновешиваться суммарным зарядом отрицательно заряженных электронов. Следовательно, число электронов в атоме всегда равно числу протонов в его ядре.
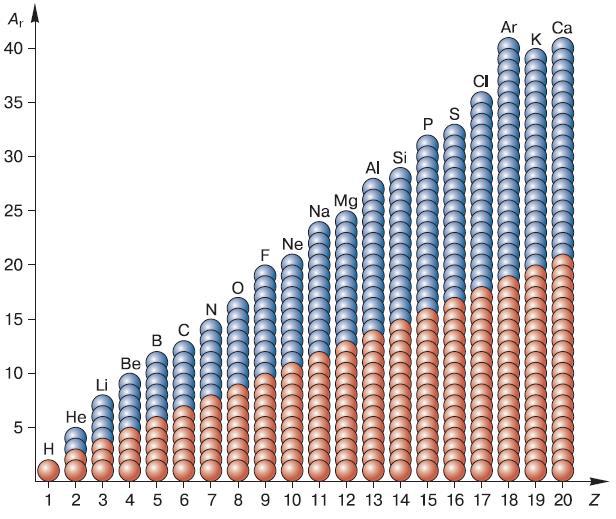
Рис. 122. Состав атомных ядер химических элементов № 1—20 таблицы Д. И. Менделеева (красные шарики – протоны; голубые – нейтроны; Z – порядковый номер элемента; Ar – массовое число, равное сумме протонов и нейтронов)
Находящиеся в ядре нейтроны, не имеющие электрического заряда, влияют на массу атома элемента, но не определяют число движущихся вокруг ядра электронов.
Химические свойства атомов элементов определяются строением их электронной оболочки. Электроны в атоме, как вы знаете, находятся в определённых областях пространства, называемых орбиталями. Этот термин был введён вместо употреблявшегося ранее понятия «орбита» для того, чтобы не складывалось ощущения, что электрон вращается вокруг ядра по какой-то конкретной линии. В действительности электрон в атоме не имеет определённой траектории движения, более того, он проявляет свойства как частицы, так и волны. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра. Наиболее вероятно нахождение электрона вблизи ядра. По мере удаления от ядра вероятность нахождения электрона в данной точке пространства постепенно снижается. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, и называется орбиталью. Орбитали атома имеют разные размеры. Электроны, находящиеся на орбиталях близкого размера, образуют электронные слои. Электронные слои называют также энергетическими уровнями. Их нумеруют, начиная от ядра: 1, 2, 3, 4 и т. д. Энергетические уровни разделяются на подуровни. Подуровни принято обозначать латинскими буквами s, р, d и т. д. На s-подуровне находится только одна орбиталь, её, как и подуровень, называют s-орбиталью. На p-подуровне находятся три p-орбитали. Орбитали имеют разную форму: так, s-орбиталь имеет форму шара, р-орбиталь – форму гантели, или объёмной восьмёрки. Каждая орбиталь обладает своим особенным количеством энергии. Известно, что на одной и той же орбитали может находиться одновременно не более двух электронов.
По мере увеличения порядкового номера элемента в периодической системе растёт содержащееся в его ядре число протонов, а вместе с ним и число электронов, находящихся на различных энергетических уровнях. На первом уровне имеется только один s-подуровень, который обозначается как 1s. Он может содержать один или два электрона. У атома водорода на этом уровне находится его единственный электрон (рис. 123, А). В ходе химического взаимодействия атомы могут отдавать или принимать электроны, превращаясь в заряженные частицы – ионы. Атом водорода легко расстаётся со своим электроном, отдавая его другим атомам и превращаясь в положительно заряженный ион Н+. Атом гелия имеет на том же уровне два электрона, поэтому его первая и единственная орбиталь оказывается заполненной (см. рис. 123, А). Новые электроны он присоединить не может, а расставаться с теми, которые находятся на завершённой внешней оболочке, энергетически невыгодно. Поэтому гелий является инертным веществом, которое не способно вступать в химические реакции.
Чем больше протонов и электронов в атоме, тем сложнее становится структура его электронной оболочки. Если первый уровень имеет только один подуровень 1s, то второй – уже два (2s и 2р), и с возрастанием номера уровня число содержащихся в нём подуровней продолжает увеличиваться (рис. 123, Б).
Химические свойства атомов во многом определяются числом электронов, расположенных на внешних уровнях электронной оболочки.

Рис. 123. Строение атома: А – схемы строения электронных оболочек атомов водорода (Н) и гелия (Не); Б – формы s– и p-орбиталей (электронных облаков)
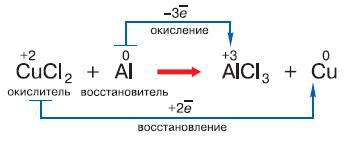
Рис. 124. Процесс обмена электронами при окислительно-восстановительной реакции
Если эти уровни содержат мало электронов, атом, вступая в химическую реакцию, стремится их отдать, если много – присоединить чужие электроны, чтобы заполнить внешнюю оболочку. Если же эта оболочка заполнена, атом становится инертным и в большинстве случаев вообще не участвует в химических реакциях. Элементы, находящиеся в начале каждого периода, содержат на внешней оболочке мало электронов и поэтому легко их отдают, превращаясь при этом в положительно заряженные ионы. Потеря электронов атомом называется окислением (рис. 124). В конце периодов, непосредственно перед инертными газами, находятся галогены (фтор, хлор, бром, иод), которым для заполнения внешней оболочки не хватает одного электрона. Поэтому они легко присоединяют электроны и становятся при этом отрицательно заряженными ионами. Этот процесс носит название восстановления. Итак, чем меньше электронов находится на внешней оболочке атома, тем активнее он их отдаёт; чем меньше электронов не хватает для заполнения внешней оболочки атома, тем активнее он их принимает.